Molecular Catalysis:腈水合酶的激活蛋白的研究進展
- 分類:行業動態
- 發布時間:2024-09-23 10:36
- 訪問量:
【概要描述】腈水合酶(NHase, EC 4.2.1.84)是一種非常有價(jia) 值的生物催化劑,能夠在溫和的條件下將腈類化合物轉化為(wei) 相應的酰胺類化合物。
Molecular Catalysis:腈水合酶的激活蛋白的研究進展
【概要描述】腈水合酶(NHase, EC 4.2.1.84)是一種非常有價(jia) 值的生物催化劑,能夠在溫和的條件下將腈類化合物轉化為(wei) 相應的酰胺類化合物。
- 分類:行業動態
- 發布時間:2024-09-23 10:36
- 訪問量:
腈水合酶(NHase, EC 4.2.1.84)是一種非常有價(jia) 值的生物催化劑,能夠在溫和的條件下將腈類化合物轉化為(wei) 相應的酰胺類化合物。

1. 腈水合酶的催化機製
利用腈水合酶作為(wei) 生物催化劑生產(chan) 的酰胺類產(chan) 品在工業(ye) 、農(nong) 業(ye) 及醫藥等領域有著極大的應用價(jia) 值。目前,腈水合酶可用於(yu) 生產(chan) 丙烯酰胺和煙酰胺等小體(ti) 積酰胺化合物,這類化合物已作為(wei) 大宗化學品廣泛使用。未來,腈水合酶還可用於(yu) 合成大體(ti) 積酰胺類化合物,這類化合物通常是高價(jia) 值藥品的原料及醫藥中間體(ti) ,具體(ti) 圖2所示:

腈水合酶基因簇上的激活蛋白能夠促進NHase的成熟,從(cong) 而影響NHase的催化能力。本篇綜述概述了激活蛋白在機製、能量利用、靈活性和表達等方麵的最新研究進展。
來自不同微生物的NHase基因簇排列方式不同,不同的基因排列方式會(hui) 呈現出NHase成熟的不同機製,文中展現了多種編碼NHase基因的基因簇,如圖3所示,其中編碼NHase的典型基因簇為(wei) 圖3A和圖3B。NHase的成熟需要NHase形成結合金屬的活性中心,NHase基因簇表達出的激活蛋白主要負責捕獲金屬離子並運輸到活性中心,通過亞(ya) 基之間的調整,從(cong) 而激活NHase。

在NHase自然成熟機製中,根據活性中心結合的金屬離子差異,NHase又可分為(wei) Co-NHases和Fe-NHases。本綜述論述了如圖4A-F所示的5種自然成熟機製,圖中藍色的球代表了Fe離子,紫色的球代表了Co離子,激活蛋白用‘γ’表示。詳細的自然成熟機製如表1所示,表中提及的“亞(ya) 基自身交換”指的是通過α-亞(ya) 基上去質子化的Cys-SO2-、Cys-SO-和β-亞(ya) 基上的兩(liang) 個(ge) 精氨酸(R52和R157)之間的鹽橋作用實現亞(ya) 基自身交換。
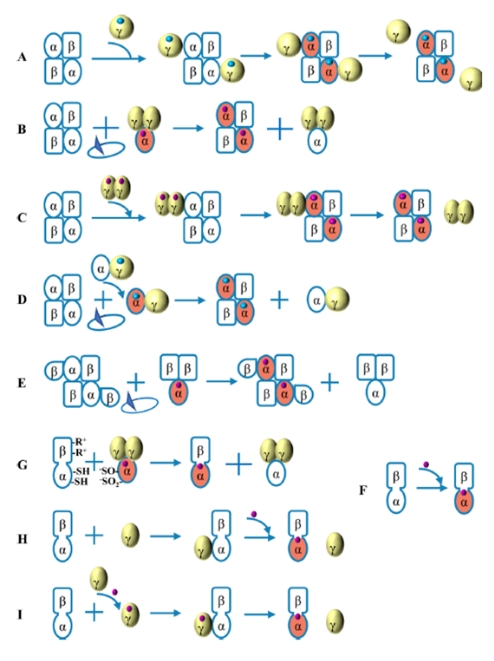 圖4. NHase的成熟機製
圖4. NHase的成熟機製
表1. NHase的自然成熟機製
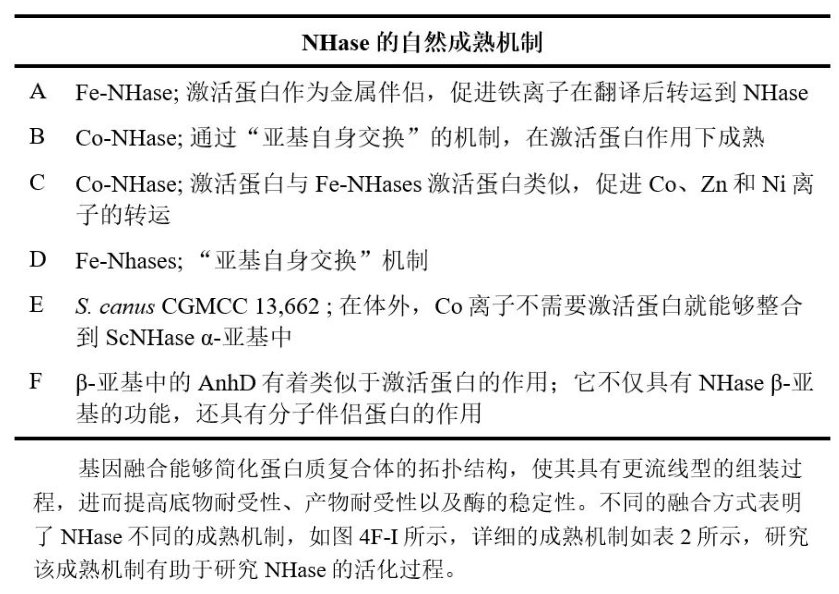
表2. NHase亞(ya) 基融合的成熟機製

二、激活蛋白在金屬離子轉運過程中充當NTPase的角色
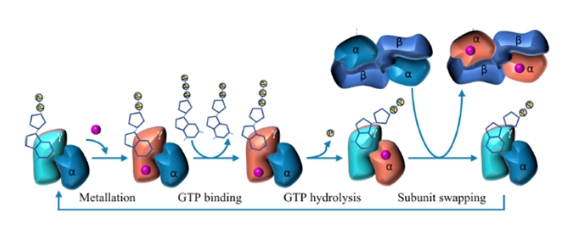
三、NHase激活蛋白的靈活性

作者信息:周哲敏:http://biotech.jiangnan.edu.cn/szdw1/jzyg/zg1/zzm.htm
研究方向:發酵工程、酶催化轉化。
原文鏈接:http://www.sciencedirect.com/science/article/abs/pii/S2468823124004905?via%3Dihub.
搜索


-
-

